Sulfat
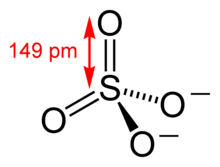
Sulfatul este, în chimia anorganică, un anion. Sulfații (compușii care conțin acest ion) sunt săruri ale acidului sulfuric.
Proprietăți chimice
Ionul sulfat este un anion poliatomic cu formula empirică SO4- și cu masa moleculară în jur de 96.06 g/mol. Acesta constă dintr-un atom central de sulf, înconjurat de patru atomi echivalenți de oxigen. Simetria este similară cu cea a metanului, CH4.
Preparare
Metodele de preparare a sulfaților ionici includ:
- Dizolvarea unui metal în acidul sulfuric
- Reacția chimică dintre un hidroxid sau oxid al unui metal cu acidul sulfuric
- Oxidarea sulfurilor sau sulfiților
Proprietăți
Sunt cunoscute multe exemple de sulfați, iar majoritatea dintre aceștia sunt greu solubili în apă. Sulfatul de calciu, sulfatul de stronțiu, sulfatul de plumb sau sulfatul de bariu sunt slab solubile. Sulfatul de radiu este cel mai insolubil sulfat cunoscut.
Utilizări
Sulfatul de bariu (BaSO4) este folosit în chimie analitică pentru detectarea anionului sulfat. Sulfații sunt importanți în chimia industrială și în sistemele biologice:
- Bateriile plumb-acid folosesc acid sulfuric.
- Sulfatul de cupru este folosit ca insecticid.
- Sulfatul de magneziu, numit și Sare Epsom, este folosit la băile terapeutice și la tratamentele digestive.
- Sulfatul de calciu hidratat, extras din mineralul natural gips, este folosit uneori la fabricarea tencuielii pentru zugrăvit.
- Ionul sulfat mai este folosit ca contra-ion pentru câteva medicamente cationice.
Istoric
Câțiva sulfați sunt cunoscuți încă de pe vremea alchimiștilor.
Alți ioni formați din sulf și oxigen
| Formula moleculară | Nume |
|---|---|
| SO52- | Peroxomonosulfat |
| SO42- | Sulfat |
| SO32- | Sulfit |
| S2O82- | Peroxodisulfat |
| S2O72- | Pirosulfat |
| S2O62- | Ditionat |
| S2O52- | Metabisulfit |
| S2O42- | Ditionit |
| S2O32- | Tiosulfat |
| S4O62- | Tetrationat |
| |||||